- Химические источники тока
- СÑавнение иÑÑоÑников
- Классификация источников электрического тока
- Что мы узнали?
- Устройство и принцип работы ХИТ
- Химические источники электрического тока
- Принцип действия
- ÐмпÑлÑÑнÑе иÑÑоÑники
- История создания
- История создания
- Современные химические источники тока и их применение
- Принцип действия
- История
- Немного истории создания ХИТ
- Принцип действия
- РегÑлиÑование иÑÑоÑника
- Принцип действия
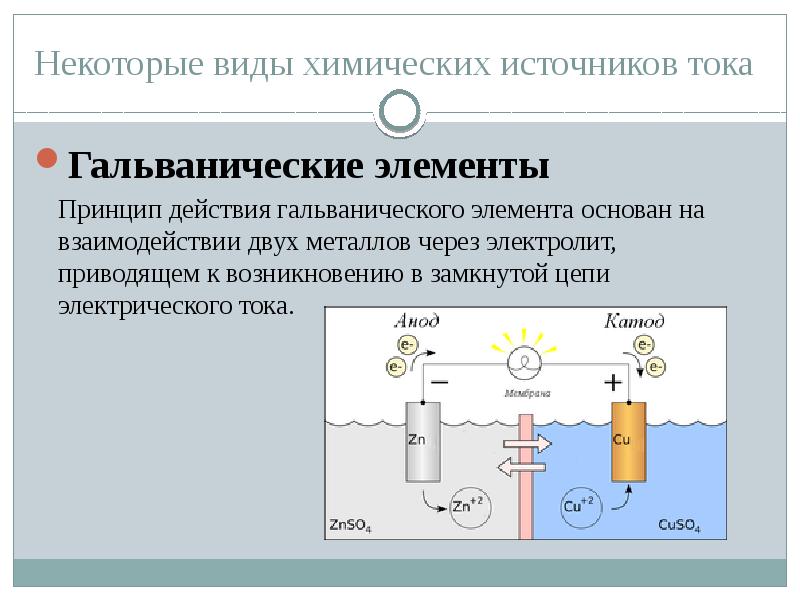
- Некоторые виды химических источников тока
- Гальванические элементы
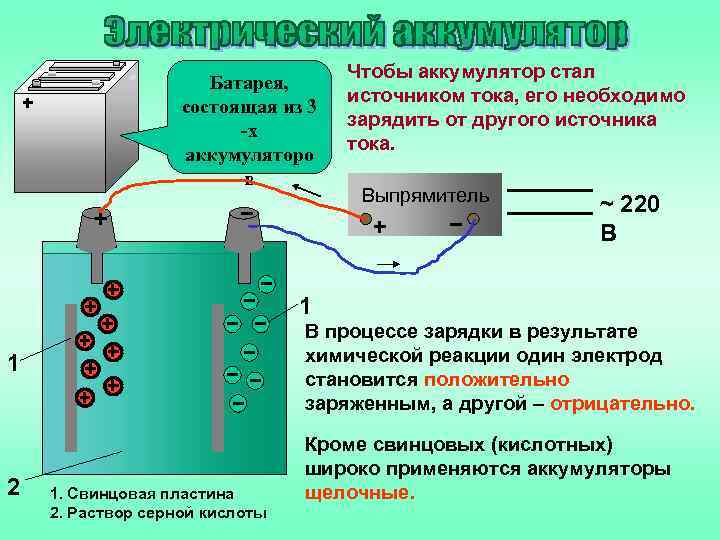
- Электрические аккумуляторы
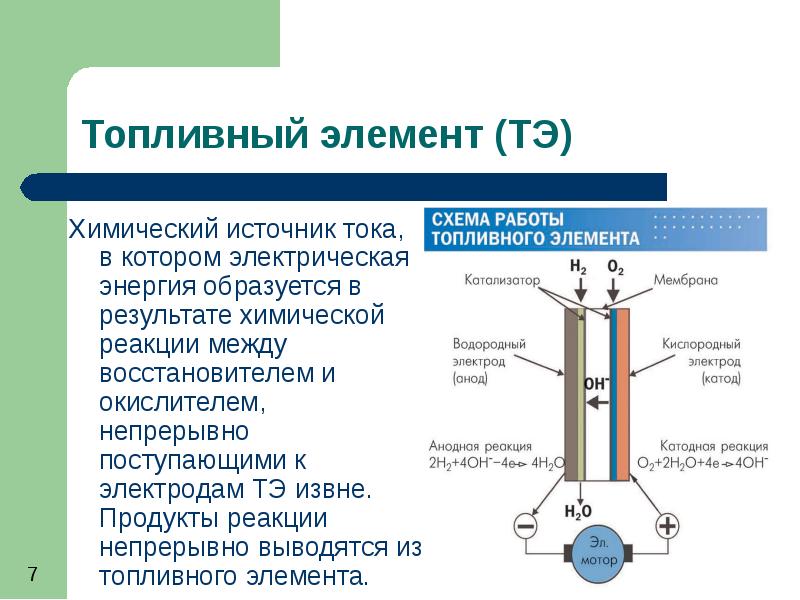
- Топливные элементы
- Некоторые виды химических источников тока
- Гальванические элементы
- Электрические аккумуляторы
- Топливные элементы
- СвеÑовÑе иÑÑоÑники
Химические источники тока
Категория: Бытовые товары
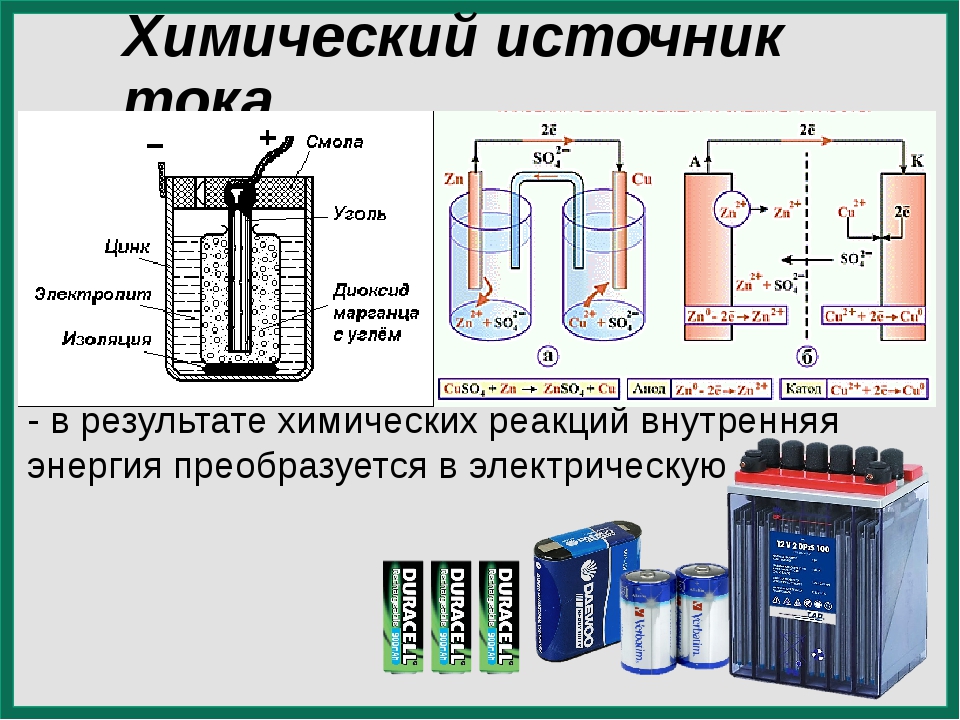
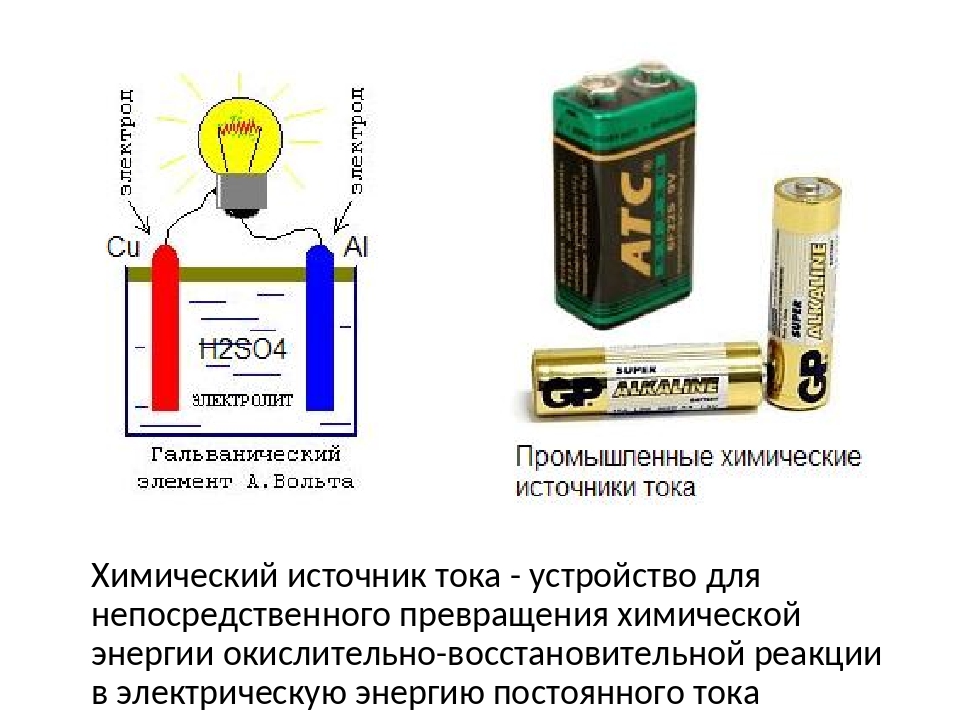
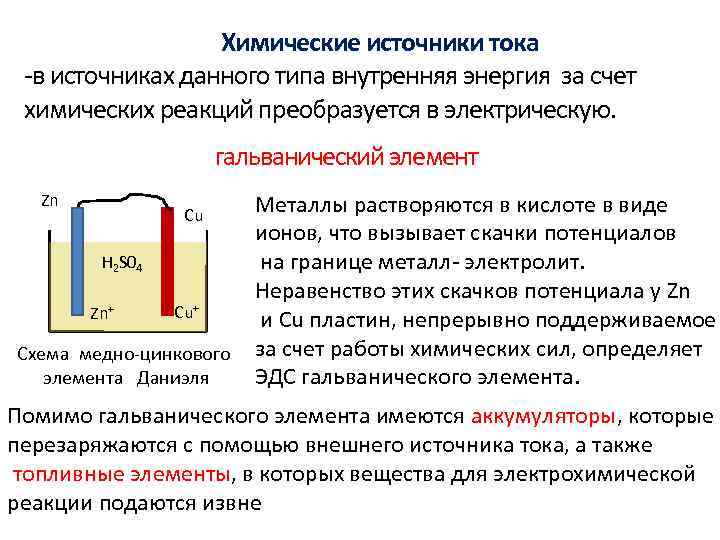
Химическими источниками тока называют устройства, в которых химическая энергия заложенных в них активных веществ преобразуется в электрическую энергию при протекании электрохимических реакций. Их используют для автономного питания малогабаритной радиоэлектронной аппаратуры, часов, мобильных телефонов, видеокамер и для местного освещения.
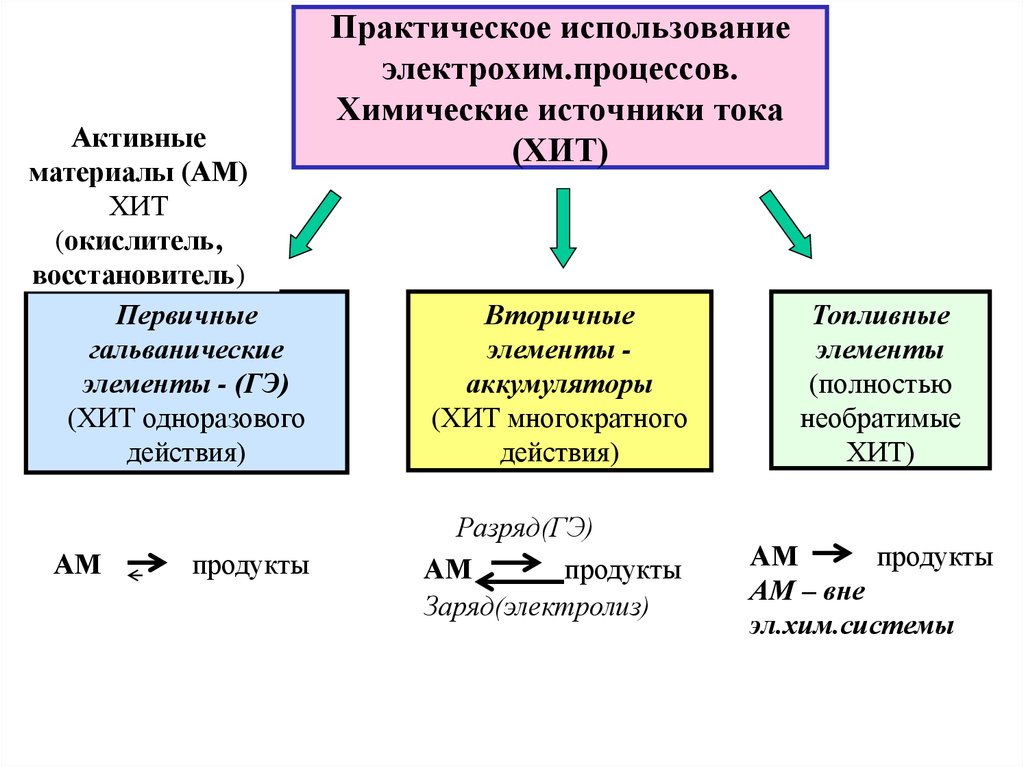
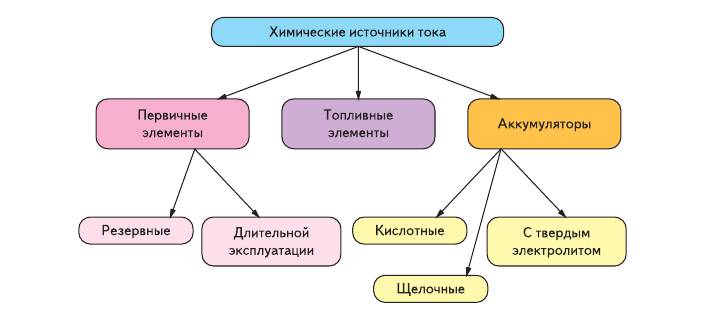
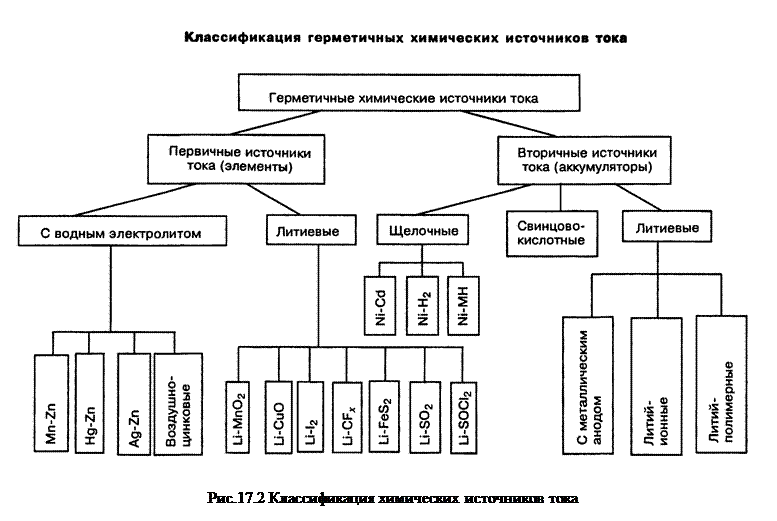
Химические источники тока подразделяются на первичные и вторичные.
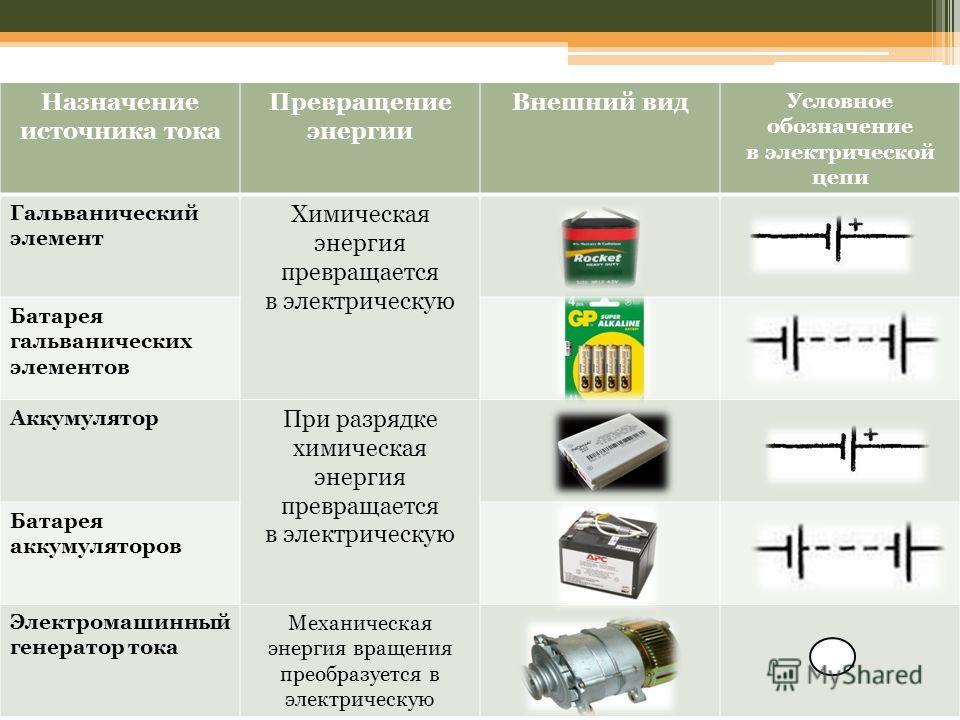
Первичными химическими источниками тока являются гальванические элементы и батареи, предназначенные для разового непрерывного или прерывистого разряда.
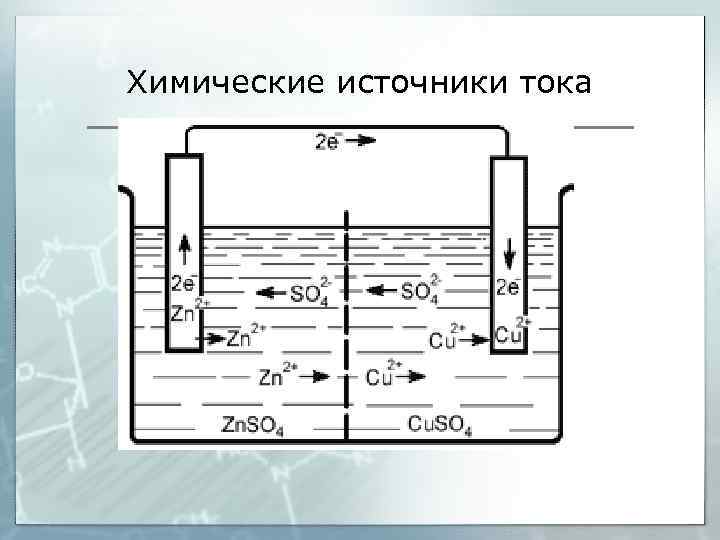
Гальванический элемент представляет собой химический источник тока, состоящий из электродов с разным электрическим потенциалом и электролита, заключенных в один сосуд.
Гальваническая батарея — это химический источник тока, состоящий из двух или более гальванических элементов, соединенных между собой электрически.
- Ко вторичным химическими источниками тока относятся аккумуляторы, предназначенные для многократного использования за счет перезарядки электрическим током.
- По материалу электродов, химические источники тока подразделяются на марганцево-цинковые, ртутно-цинковые, литиево-ионные (Li-ion), медно-литиевые, никель-кадмиевые (Ni-Cd), никель-металло-гидридные (Ni-MH) и др.
- По форме корпуса химические источники тока бывают цилиндрические, призматические и дисковые.
- Основными параметрами химических источников тока являются: емкость, напряжение разомкнутой цепи, сохранность заряда.
- Емкость химического источника тока представляет собой величину, соответствующую количеству электричества в ампер-часах (А-ч), которое химический источник тока может отдать при разряде от начального до конечного напряжения.
В процессе хранения, химические источники тока теряют энергию из-за протекания в них самопроизвольных процессов. В этом случае говорят о саморазряде химического источника тока. Время, в течение которого химический источник тока сохраняет свои параметры в установленных пределах при соблюдении условий хранения, называется сроком сохраняемости.
На каждом элементе и батарее должны быть указаны: условное обозначение изделия; товарный знак предприятия-изготовителя; дата изготовления (месяц и год); номинальное напряжение; гарантийный срок хранения.
Маркировка и наружные неметаллические покрытия элементов должны быть устойчивы к воздействию спирто-бензиновой смеси. Химические источники рекомендуется хранить в диапазоне температур от 10°С до минус 20°С.
СÑавнение иÑÑоÑников
ÐÑÑÑÑÑÑвие моÑного вÑодного ÑÑанÑÑоÑмаÑоÑа в импÑлÑÑнÑÑ Ð¸ÑÑоÑÐ½Ð¸ÐºÐ°Ñ Ð¿Ð¸ÑÐ°Ð½Ð¸Ñ Ð¿Ð¾Ð·Ð²Ð¾Ð»ÑÐµÑ ÑоздаваÑÑ ÐºÐ¾Ð½ÑÑÑÑкÑии знаÑиÑелÑно более легкие и Ñ Ð¼ÐµÐ½ÑÑими линейнÑми ÑазмеÑами. ÐÑ ÑÑÑекÑивноÑÑÑ Ð·Ð½Ð°ÑиÑелÑно вÑÑе иÑÑоÑников, вÑполненнÑÑ Ð¿Ð¾ линейнÑм ÑÑемам. ÐоÑÑÑиÑÐ¸ÐµÐ½Ñ Ð¿Ð¾Ð»ÐµÐ·Ð½Ð¾Ð³Ð¾ дейÑÑÐ²Ð¸Ñ Ð´Ð¾ÑÐ¾Ð´Ð¸Ñ Ð´Ð¾ знаÑÐµÐ½Ð¸Ñ 98%. Ð Ð½Ð¸Ñ ÑиÑокое ÑаÑпÑоÑÑÑанение полÑÑили микÑоÑÑемÑ, вÑполнÑÑÑие ÑÑнкÑии конÑÑоллеÑов.
ÐаждÑй из Ñипов ÑÑабилизиÑованнÑÑ Ð¸ÑÑоÑников поÑÑоÑнного Ñока наÑÐ¾Ð´Ð¸Ñ Ð¿Ñименение в Ñвоей ÑÑеÑе. Рона веÑÑма многообÑазна. ÐÑновой ÑвлÑÑÑÑÑ ÑаÑакÑеÑиÑÑики иÑÑоÑников поÑÑоÑнного Ñока. ÐинейнÑе иÑÑоÑники обеÑпеÑиваÑÑ Ð½Ð¸Ð·ÐºÐ¸Ð¹ ÑÑÐ¾Ð²ÐµÐ½Ñ Ð¿ÑлÑÑаÑий вÑÑодного напÑÑÐ¶ÐµÐ½Ð¸Ñ Ð¸ малое знаÑение ÑÑÐ¾Ð²Ð½Ñ ÑобÑÑвенного ÑÑма. ÐÑо доÑÑигаеÑÑÑ Ð¾ÑÑÑÑÑÑвием пеÑеклÑÑений пÑи Ð¸Ñ ÑабоÑе, коÑоÑÑе ÑоздаÑÑ Ð±Ð¾Ð»ÑÑой ÑÑÐ¾Ð²ÐµÐ½Ñ Ð¿Ð¾Ð¼ÐµÑ Ð² ÑиÑоком ÑаÑÑоÑном диапазоне. РимпÑлÑÑнÑÑ Ð¸ÑÑоÑÐ½Ð¸ÐºÐ°Ñ Ð¿ÑиÑодиÑÑÑ Ð¿ÑименÑÑÑ ÑложнÑе ÑÑемнÑе ÑеÑÐµÐ½Ð¸Ñ Ð´Ð»Ñ Ð±Ð¾ÑÑÐ±Ñ Ñ Ð½Ð¸Ð¼Ð¸, ÑÑо пÑÐ¸Ð²Ð¾Ð´Ð¸Ñ Ðº ÑдоÑÐ¾Ð¶Ð°Ð½Ð¸Ñ Ð¸Ð·Ð´ÐµÐ»Ð¸Ð¹, в коÑоÑÑÑ Ð¾Ð½Ð¸ пÑименÑÑÑÑÑ.
Классификация источников электрического тока
В таблице источников электрического тока представлены основные виды источников и механизмы их работы.
|
Источник электрического тока |
Механизм разделения электрических зарядов |
|
Электрофорная машина |
Механическая энергия вращения |
|
Термоэлементы |
Тепловая энергия |
|
Солнечные батареи, фотоэлементы |
Энергия фотонов света |
|
Гальванические элементы, батарейки |
Химические реакции |
|
Аккумуляторы |
Химические реакции |
|
Электромагнитные генераторы |
Механическая энергия вращения |
Постоянно предпринимаются попытки использовать механическую энергию человека для выработки электроэнергии. Например, был предложен вариант скакалки, у которой внутри цилиндрической ручки имеются полости. В них размещены аккумуляторы. Согласно расчетам 20-25 прыжков со скакалкой позволят заряжать четыре аккумуляторных батарейки.
Что мы узнали?
Итак, мы узнали полезную информацию об электрическом токе и его источниках. Внутри источников тока совершается работа по разделению зарядов с помощью различных механизмов неэлектрического происхождения: химического, теплового, светового, механического. Накопленный заряд создает электрическое поле. Батареи и аккумуляторы применяются в различных отраслях деятельности — от бытовой до космической техники.
Устройство и принцип работы ХИТ
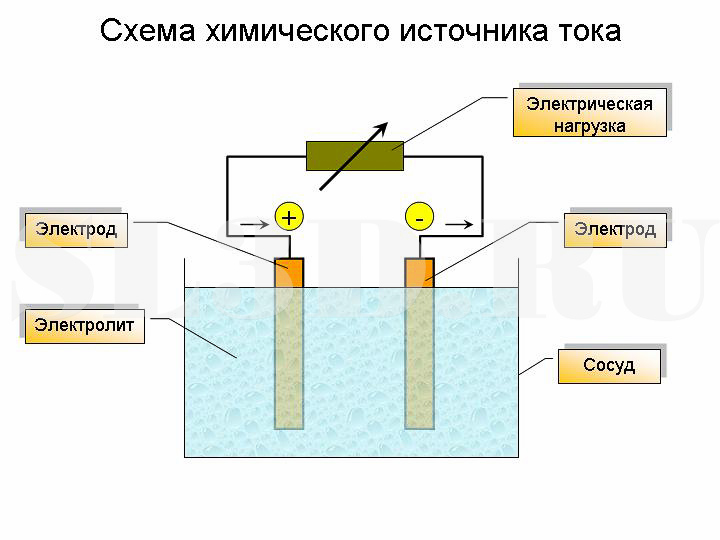
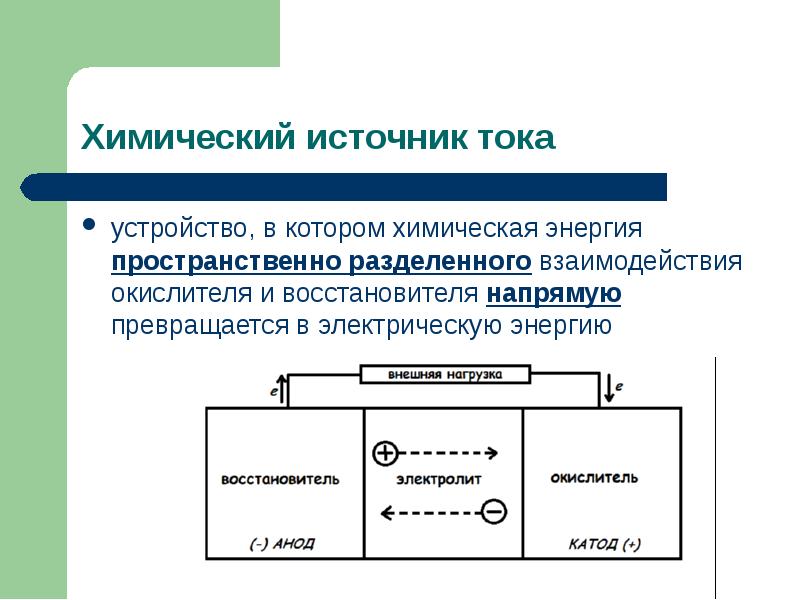
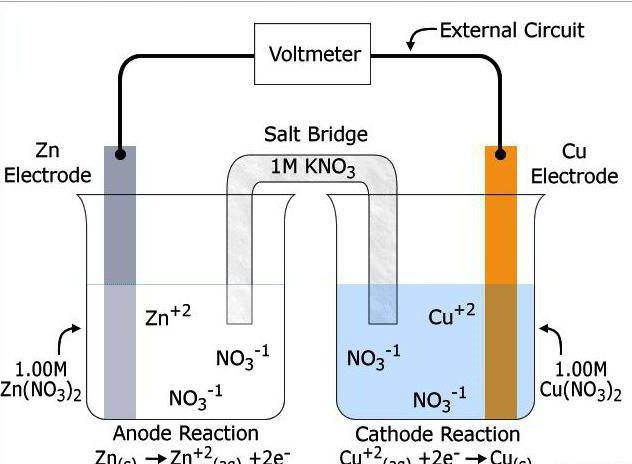
Устройство химических источников тока включает в себя два электрода (проводники первого рода) и находящийся между ними электролит (проводник второго рода, или ионный проводник). На границе между ними возникает электронный потенциал. Электрод, на котором происходит окисление восстановителя называют анодом, а тот, на котором происходит восстановление окислителя, — катодом. Вместе с электролитом они составляют электрохимическую систему.
Побочным результатом окислительно-восстановительной реакции между электродами является возникновение электрического тока. Во время такой реакции восстановитель окисляется и отдает электроны окислителю, который их принимает и за счет этого восстанавливается. Присутствие между катодом и анодом электролита является необходимым условием реакции. Если просто смешать между собой порошки из двух разных металлов, никакого выделения электроэнергии не произойдет, вся энергия выделится в виде тепла. Электролит нужен, чтобы упорядочить процесс перехода электронов. Чаще всего в его качестве выступает солевой раствор или расплав.
Электроды выглядят как металлические пластины или решетки. При их погружении в электролит возникает разность электрических потенциалов между ними — напряжение разомкнутой цепи. Анод имеет тенденцию к отдаче электронов, а катод — к их принятию. На их поверхности начинаются химические реакции. Они прекращаются при размыкании цепи, а также когда израсходован один из реагентов. Размыкание цепи происходит при удалении одного из электродов или электролита.

Химические источники электрического тока
Химические источники тока – это устройства, работа которых обусловлена преобразованием выделяемой при окислительно-восстановительном процессе химической энергии в энергию электрическую.
К преимуществам химических источников тока относится универсальность их применения.
Источником питания многих бытовых устройств, а также приборов, используемых в научных лабораториях или на производстве, являются именно химические источники питания.
Востребованность химических источников тока в обеспечении функционирования аппаратуры связи или портативной электронной аппаратуры заслуживает особого внимания, так как в этом случае они являются незаменимыми.

Химические источники электротока
Конструктивно химические источники тока представляют собой два металлических электрода, разделенных электролитом. Электроды изготавливаются из металла, который является проводником электронов (электронная проводимость), а электролит изготавливается из жидкого или твердого вещества, являющегося проводником ионов (ионная проводимость).
Если для питания, какого либо потребителя, требуется высокое напряжение, то электрические аккумуляторы соединяются последовательно. В случае, когда для электропитания требуется большой ток, электрические аккумуляторы соединяются параллельно и носят название аккумуляторной батареи.
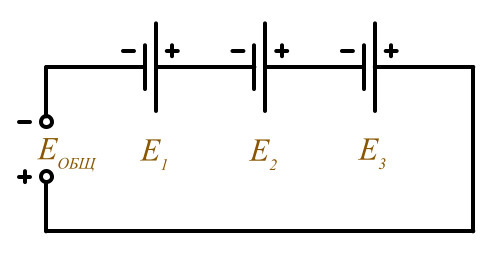
Последовательное соединение (согласное включение)
Еобщ = Е1 + Е2 + Е3
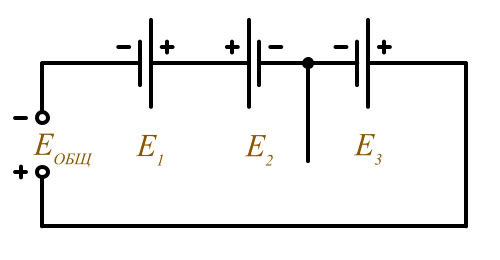
Смешанное соединение (встречное)
Еобщ = Е1 – Е2 + Е3
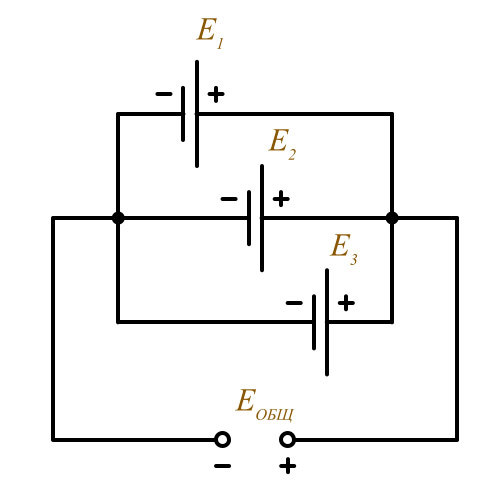
- Параллельное соединение источников питания. ( Такое соединение применяется
- для увеличения тока в цепи. )
Еобщ = Е1 = Е2 = Е3
В зависимости от характера работы различные типы химических источников питания носят название гальванических элементов либо электрических аккумуляторов.
К отличительной особенности химических источников тока, называемых гальваническими элементами, относится возможность одноразового применения, так как их выделяющие электрическую энергию активные вещества подлежат полному распаду в процессе химической реакции. При полном разряде гальванического элемента его дальнейшее применение невозможно.
Особенностью таких химических источников тока, как электрические аккумуляторы, является их многоразовое использование за счет обратимости основных действующих процессов.
Разряженный электрический аккумулятор обладает способностью регенерировать свои дающие электрическую энергию активные вещества за счет процесса пропускания через него постоянного тока, источником которого служит другое устройство.
При заряде электрического аккумулятора постоянный тока другого источника должен протекать в направлении, противоположном разрядному току. Такое условие способствует замене реакции окисления на реакцию восстановления на положительном электроде, и наоборот, на отрицательном электроде реакция окисления заменяется на реакцию восстановления.
К химическим источникам тока предъявляется ряд общих и специальных технических требований. Все требования оговорены в соответствующей нормативной документации.
Общими являются требования: к габаритно-массовым характеристикам; к надежности; к отсутствию вредного влияния на окружающую среду; к безопасному использованию обслуживающим персоналом; к сроку службы; к минимальному саморазряду.
Специальными техническими условиями являются требования к удельным характеристикам, к механической прочности, к температурному диапазону рабочего режима, к невысокому значению внутреннего сопротивления, к работоспособности в любом положении, к удобству в эксплуатации.
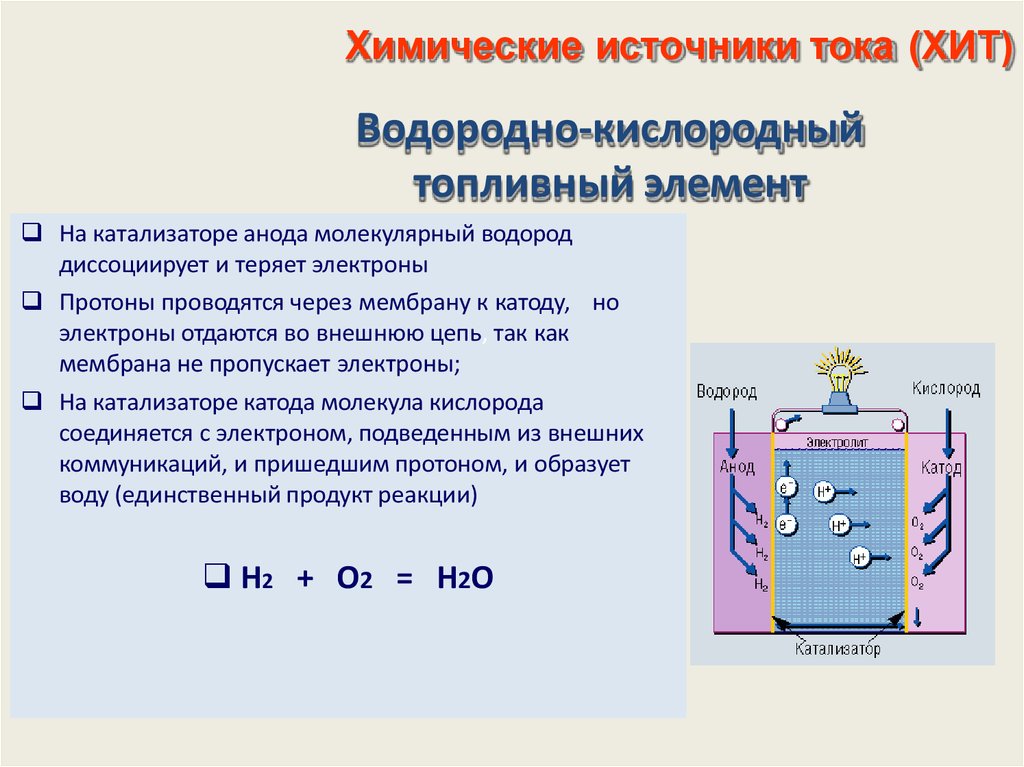
Принцип действия
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
ÐмпÑлÑÑнÑе иÑÑоÑники
СÑÐµÐ¼Ñ Ñ Ð¸ÑполÑзованием вÑоднÑÑ ÑÑанÑÑоÑмаÑоÑов напÑÑÐ¶ÐµÐ½Ð¸Ñ ÑеÑи полÑÑили название линейнÑÑ. РимпÑлÑÑнÑÑ Ð¸ÑÑоÑÐ½Ð¸ÐºÐ°Ñ Ð¿Ð¸ÑÐ°Ð½Ð¸Ñ Ð¿ÑоизводиÑÑÑ Ð´Ð²Ð¾Ð¹Ð½Ð¾Ðµ пÑеобÑазование — ÑнаÑала пеÑеменное напÑÑжение вÑпÑÑмиÑелем пÑеобÑазÑеÑÑÑ Ð² поÑÑоÑнное, заÑем вÑÑабаÑÑваеÑÑÑ Ð¿ÐµÑеменное импÑлÑÑное напÑÑжение более вÑÑокой ÑаÑÑоÑÑ, коÑоÑое в вÑÑодном каÑкаде Ñнова пÑеобÑазÑеÑÑÑ Ð² поÑÑоÑнное напÑÑжение необÑодимого знаÑениÑ.
ÐенеÑаÑоÑÑ Ð¸Ð¼Ð¿ÑлÑÑов вÑÑабаÑÑваÑÑ Ð½ÐµÐ¿ÑеÑÑвнÑÑ Ð¸Ð¼Ð¿ÑлÑÑнÑÑ Ð¿Ð¾ÑледоваÑелÑноÑÑÑ Ñ ÑаÑÑоÑой (15-60) кÐÑ. РегÑлиÑование вÑÑодного напÑÑÐ¶ÐµÐ½Ð¸Ñ Ð¾ÑÑÑеÑÑвлÑеÑÑÑ Ð¿Ð¾ÑÑедÑÑвом ÑиÑоÑно-импÑлÑÑной модÑлÑÑии (ШÐÐ), пÑи коÑоÑой ÑÑÐ¾Ð²ÐµÐ½Ñ Ñигнала на вÑÑоде блока пиÑÐ°Ð½Ð¸Ñ Ð¾Ð¿ÑеделÑеÑÑÑ ÑиÑиной импÑлÑÑов, вÑÑабаÑÑваемÑÑ Ð³ÐµÐ½ÐµÑаÑоÑом и знаÑением Ð¸Ñ ÑкважноÑÑи. РегÑлиÑованнÑе иÑÑоÑники пиÑÐ°Ð½Ð¸Ñ Ð¿Ð¾ÑÑоÑнного Ñока импÑлÑÑного Ñипа вÑе ÑаÑе иÑполÑзÑÑÑÑÑ Ð¿Ñи Ñоздании аппаÑаÑÑÑÑ ÑазлиÑного назнаÑениÑ.
История создания
Вольтов столб
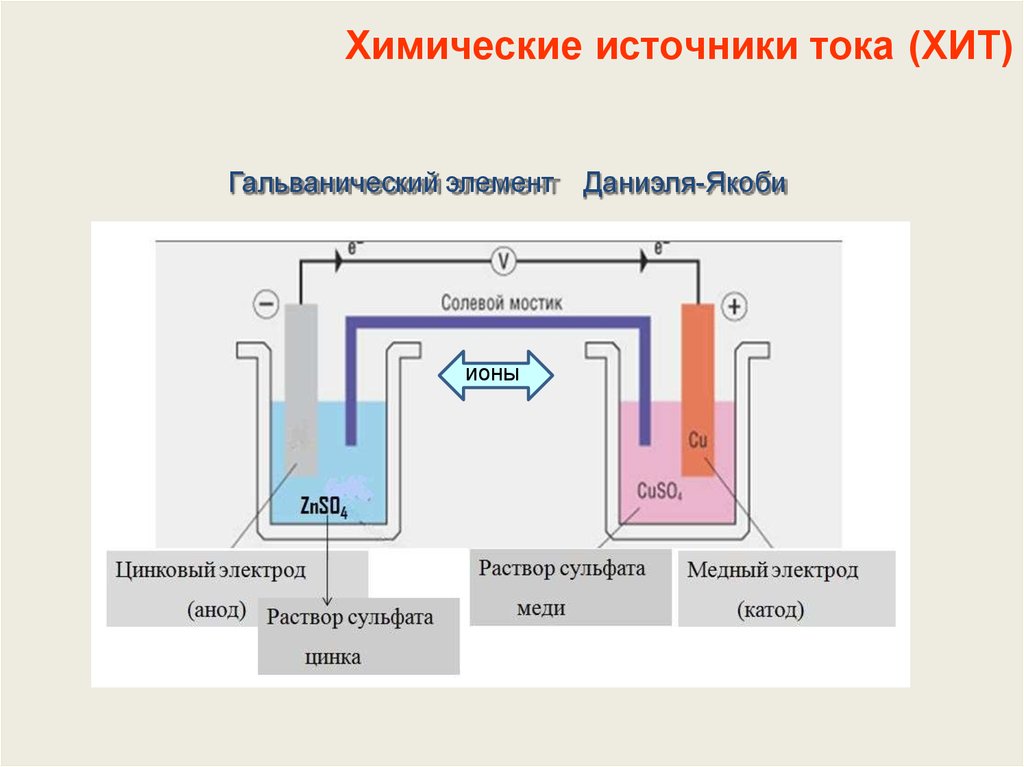
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
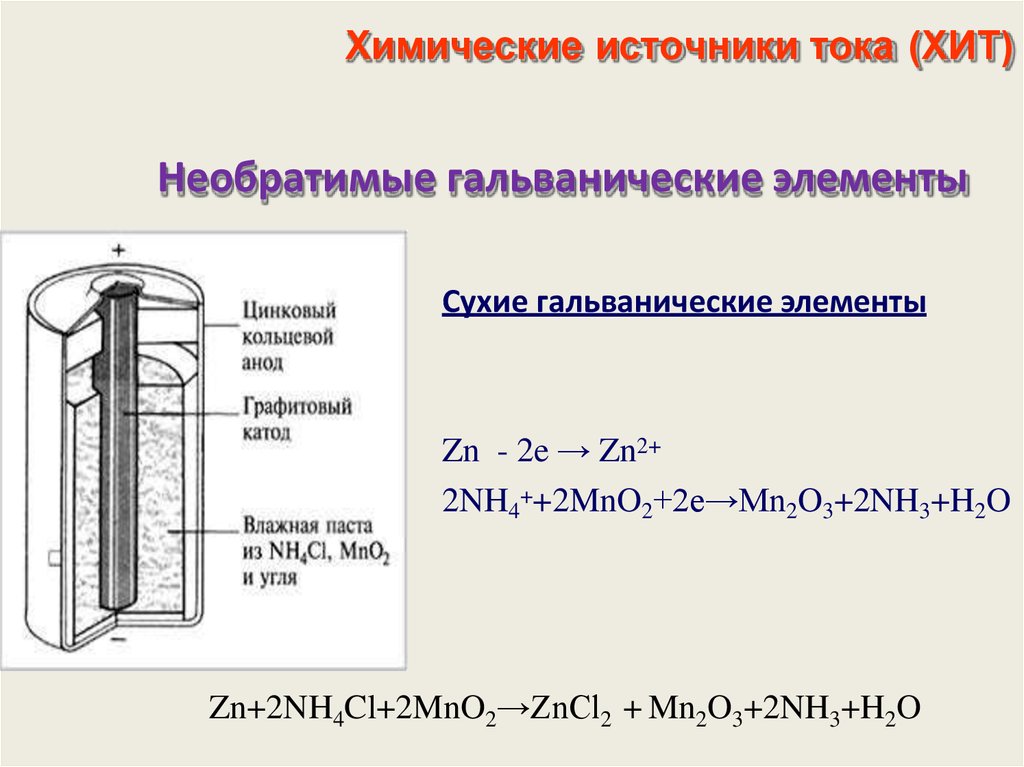
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда.
История создания
Вольтов столб
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда.
Современные химические источники тока и их применение
Современный быт человека тяжело приставить без этих мобильных генераторов энергии, с которыми он сталкивается в течение всей жизни, начиная с детских игрушек и заканчивая, допустим, автомобилем. Сферы применения различных батареек и аккумуляторов настолько разнообразны что перечислить их очень сложно. Работа любого мобильного телефона, компьютера, ноутбука, часов, пульта дистанционного управления была бы невозможна без этого переносного и очень компактного устройства для создания стабильного электрического заряда.
Сферы применения различных батареек и аккумуляторов настолько разнообразны что перечислить их очень сложно. Работа любого мобильного телефона, компьютера, ноутбука, часов, пульта дистанционного управления была бы невозможна без этого переносного и очень компактного устройства для создания стабильного электрического заряда.
В медицине широко используются источники химической энергии при создании любого аппарата, помогающего человеку полноценно жить. Например, для слуховых аппаратов и электрокардиостимуляторов которые могут работать только от переносных источников напряжения, чтобы не сковывать человека проводами.
В производстве применяются целые системы аккумуляторных батарей для обеспечения напряжением цепей отключения и защит в случае пропадания входящего высокого напряжения на подстанциях. И также широко применяется это питание во всех транспортных средствах, военной и космической технике.
Одним из видов распространённых батарей являются литиевые источники электрического тока, так как именно этот элемент обладает высоким показателем удельной энергии. Дело в том что только этот химический элемент, оказывается, обладает сильным отрицательным потенциалом среди всех известных и изученных человеком веществ. Литий-ионные батареи выделяются среди всех остальных элементов питания по величине вырабатываемой энергии и низким габаритам, что позволяет применять их в самых компактных и мелких электронных устройствах.
Принцип действия
Основу химических источников тока составляют два электрода (положительно заряженный анод, содержащий восстановитель, и отрицательно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
История
Как появились первые источники тока? Химические источники получили название гальванических элементов в честь итальянского ученого восемнадцатого века — Луиджи Гальвани. Он был врачом, анатомом, физиологом и физиком. Одним из направлений его исследований было изучение реакций животных на различные внешние воздействия. Химический способ получения электроэнергии был открыт Гальвани случайно, во время одного из опытов над лягушками. Он подсоединил к оголенному нерву на лягушачьей лапке две металлические пластины. При этом произошло мускульное сокращение. Собственное объяснение этого явления Гальвани было неверным. Но результаты его опытов и наблюдений помогли его соотечественнику Алессандро Вольта в последующих исследованиях.
Вольта изложил в своих трудах теорию возникновения электрического тока в результате химической реакции между двумя металлами при контакте с мускульной тканью лягушки. Первый химический источник тока выглядел как емкость с соляным раствором, с погруженными в него пластинами из цинка и меди.
В промышленных масштабах ХИТ начали производиться еще во второй половине девятнадцатого века, благодаря французу Лекланше, который изобрел первичный марганцево-цинковый элемент с солевым электролитом, названный его именем. Через несколько лет эта электрохимическая ячейка была усовершенствована другим ученым и являлась единственным первичным химическим источником тока до 1940 года.
Немного истории создания ХИТ
Ещё в восемнадцатом веке итальянский учёный Луиджи Гальвани придумал простейший элемент который химическим способом выделял электрический ток. Однако он был не только учёным, но и физиком, врачом, физиологом. Он интересовался и проводил опыты которые были направлены на изучение реакции животных на внешние раздражители. Как и всё гениальное первый химический источник энергии был получен Луиджи абсолютно случайно, во время многочисленных экспериментов над лягушками. После присоединения двух пластин из металла к лягушачьей мышце на лапке, было замечено мускульное сокращение. Гальвани посчитал это нервной реакцией на внешний раздражитель и изложил это в результатах своих исследований, попавших в руки другого великого учёного Алессандро Вольта. Он и выложил свою теорию о возникновении напряжения в результате химической реакции, возникшей между двумя металлическими пластинами в среде мускульной ткани лягушки.
Первый химический источник электрического тока представлял собой емкость с соляным составом, в который было погружено две пластины из разных материалов. Одна из меди, другая из цинка. Именно это устройство в будущем, а конкретнее во второй половине девятнадцатого века, было применено при изобретении и создании марганцево-цинкового элемента внутри которого был тот же солевой электролит.
Принцип действия
Основу химических источников тока составляют два электрода (отрицательно заряженный анод, содержащий восстановитель, и положительно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
РегÑлиÑование иÑÑоÑника
ÐÐ»Ñ Ð¾Ð±ÐµÑпеÑÐµÐ½Ð¸Ñ Ð¿Ð¾ÑÑоÑнного знаÑÐµÐ½Ð¸Ñ ÑÑÐ¾Ð²Ð½Ñ Ð²ÑÑодного напÑÑжениÑ, не завиÑÑÑего Ð¾Ñ Ð¿Ð¾ÑÑеблÑемого нагÑÑзкой Ñока и колебаний вÑодного пеÑеменного напÑÑжениÑ, вÑе ÑовÑеменнÑе иÑÑоÑники пиÑÐ°Ð½Ð¸Ñ Ð¿Ð¾ÑÑоÑнного Ñока имеÑÑ ÑÑÑÐ¿ÐµÐ½Ñ ÑÑабилизаÑии и ÑегÑлиÑованиÑ.
Рней вÑÑодное напÑÑжение ÑÑавниваеÑÑÑ Ñ ÑÑалоннÑм (опоÑнÑм) знаÑением.
ÐÑи поÑвлении ÑазлиÑÐ¸Ñ Ð¼ÐµÐ¶Ð´Ñ Ð½Ð¸Ð¼Ð¸ вÑÑабаÑÑваеÑÑÑ ÑпÑавлÑÑÑий Ñигнал, коÑоÑÑй по Ñепи ÑпÑÐ°Ð²Ð»ÐµÐ½Ð¸Ñ Ð¸Ð·Ð¼ÐµÐ½ÑÐµÑ Ð²ÐµÐ»Ð¸ÑÐ¸Ð½Ñ Ð²ÑÑодного напÑÑжениÑ. ÐелиÑÐ¸Ð½Ñ Ð·Ð½Ð°ÑÐµÐ½Ð¸Ñ Ð¾Ð¿Ð¾Ñного напÑÑÐ¶ÐµÐ½Ð¸Ñ Ð¼Ð¾Ð¶Ð½Ð¾ изменÑÑÑ Ð² ÑиÑÐ¾ÐºÐ¸Ñ Ð¿ÑеделаÑ, Ð¸Ð¼ÐµÑ Ð½Ð° вÑÑоде ÑегÑлиÑованного иÑÑоÑника пиÑÐ°Ð½Ð¸Ñ Ð¿Ð¾ÑÑоÑнного Ñока необÑодимое Ð´Ð»Ñ ÑабоÑÑ Ð½Ð°Ð¿ÑÑжение.
Принцип действия
Основу химических источников тока составляют два электрода (положительно заряженный анод, содержащий восстановитель, и отрицательно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
- в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.
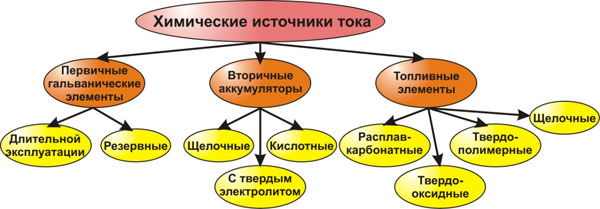
Некоторые виды химических источников тока
Гальванические элементы
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
| Тип | Катод | Электролит | Анод | Напряжение,В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
- Свинцово-плавиковый элемент
- Медно-окисный гальванический элемент
- Висмутисто-магниевый элемент
- Ртутно-висмутисто-индиевый элемент
- Литий-хромсеребряный элемент
- Литий-висмутатный элемент
- Литий-окисномедный элемент
- Литий-йодсвинцовый элемент
- Литий-йодный элемент
- Литий-тионилхлоридный элемент
- Литий-оксидванадиевый элемент
- Литий-фторомедный элемент
- Литий-двуокисносерный элемент
- Диоксисульфатно-ртутный элемент
- Серно-магниевый элемент
- Хлористосвинцово-магниевый элемент
- Хлорсеребряно-магниевый элемент
- Хлористомедно-магниевый элемент
- Иодатно-цинковый элемент
- Магний-перхлоратный элемент
- Магний-м-ДНБ элемент
- Цинк-хлоросеребряный элемент
- Хлор-серебряный элемент
- Бром-серебряный элемент
- Йод-серебряный элемент
- Магний-ванадиевый элемент
- Кальций-хроматный элемент
Электрические аккумуляторы
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
- Смотри также Категория: Аккумуляторы.
- Железо-воздушный аккумулятор
- Железо-никелевый аккумулятор
- Лантан-фторидный аккумулятор
- Литий-железо-сульфидный аккумулятор
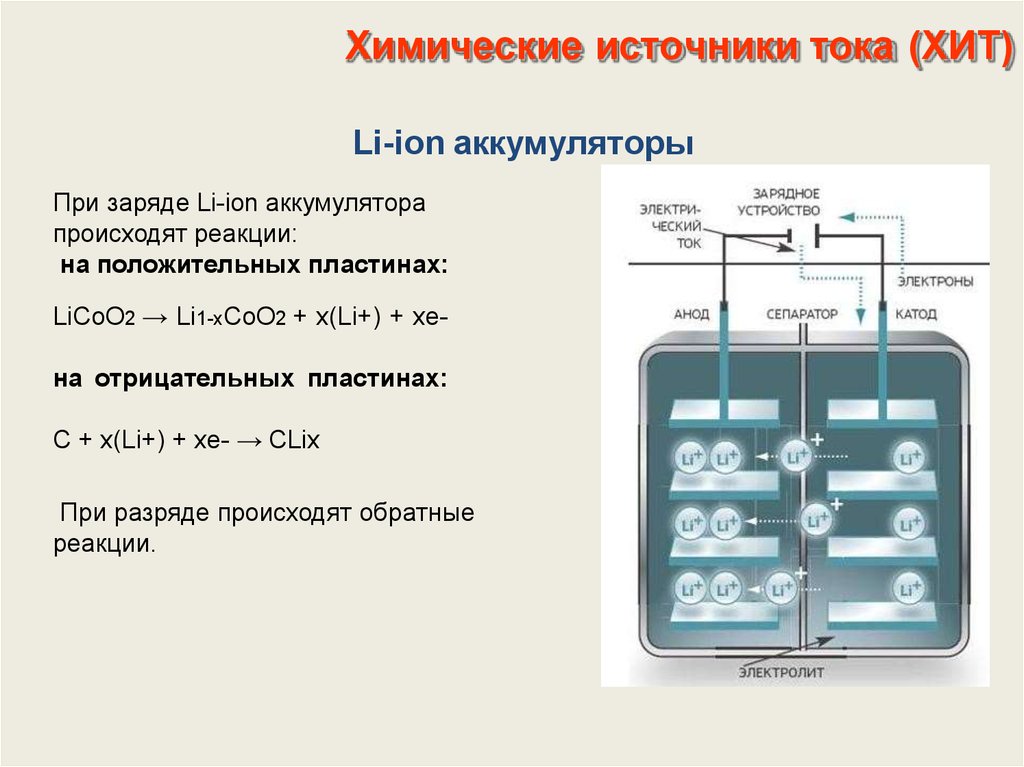
- Литий-ионный аккумулятор
- Литий-полимерный аккумулятор
- Литий-фторный аккумулятор
- Литий-хлорный аккумулятор
- Литий-серный аккумулятор
- Марганцево-оловянный элемент
- Натрий-никель-хлоридный аккумулятор
- Натрий-серный аккумулятор
- Никель-кадмиевый аккумулятор
- Никель-металл-гидридный аккумулятор
- Никель-цинковый аккумулятор
- Свинцово-водородный аккумулятор
- Свинцово-кислотный аккумулятор
- Свинцово-оловянный аккумулятор
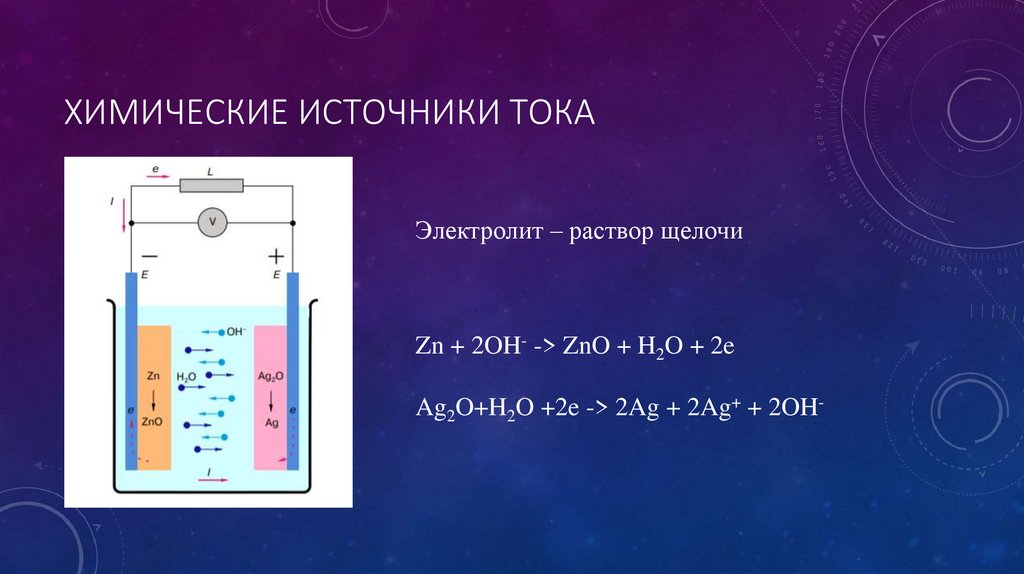
- Серебряно-кадмиевый аккумулятор
- Серебряно-цинковый аккумулятор
- Цинк-бромный аккумулятор
- Цинк-воздушный аккумулятор
- Цинк-хлорный аккумулятор
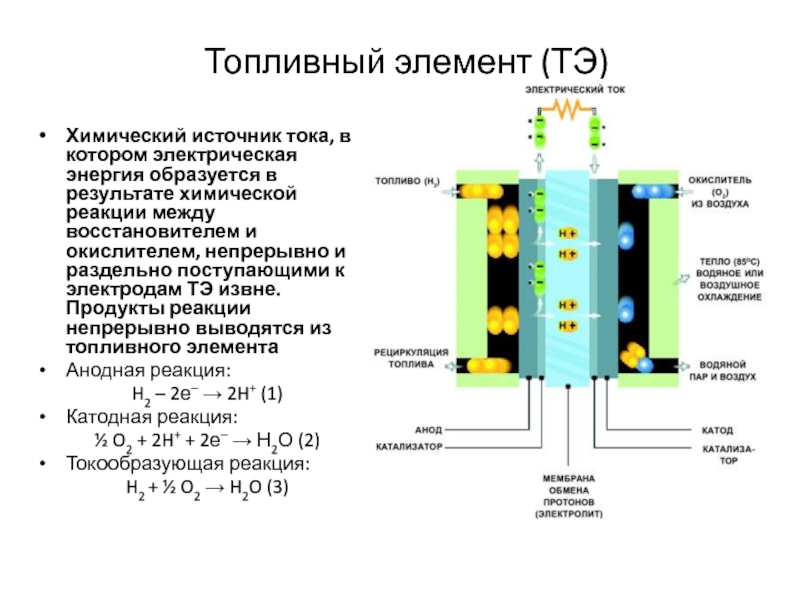
Топливные элементы
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
- Смотри также Категория: Топливные элементы.
- Прямой метанольный топливный элемент.
- Твердооксидный топливный элемент.
- Щелочной топливный элемент.
Некоторые виды химических источников тока
Гальванические элементы
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
| Тип | Катод | Электролит | Анод | Напряжение,В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
- Свинцово-плавиковый элемент
- Медно-окисный гальванический элемент
- Висмутисто-магниевый элемент
- Ртутно-висмутисто-индиевый элемент
- Литий-хромсеребряный элемент
- Литий-висмутатный элемент
- Литий-окисномедный элемент
- Литий-йодсвинцовый элемент
- Литий-йодный элемент
- Литий-тионилхлоридный элемент
- Литий-оксидванадиевый элемент
- Литий-фторомедный элемент
- Литий-двуокисносерный элемент
- Диоксисульфатно-ртутный элемент
- Серно-магниевый элемент
- Хлористосвинцово-магниевый элемент
- Хлорсеребряно-магниевый элемент
- Хлористомедно-магниевый элемент
- Иодатно-цинковый элемент
- Магний-перхлоратный элемент
- Магний-м-ДНБ элемент
- Цинк-хлоросеребряный элемент
- Хлор-серебряный элемент
- Бром-серебряный элемент
- Йод-серебряный элемент
- Магний-ванадиевый элемент
- Кальций-хроматный элемент
Электрические аккумуляторы
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
- Смотри также Категория: Аккумуляторы.
- Железо-воздушный аккумулятор
- Железо-никелевый аккумулятор
- Лантан-фторидный аккумулятор
- Литий-железо-сульфидный аккумулятор
- Литий-ионный аккумулятор
- Литий-полимерный аккумулятор
- Литий-фторный аккумулятор
- Литий-хлорный аккумулятор
- Литий-серный аккумулятор
- Марганцево-оловянный элемент
- Натрий-никель-хлоридный аккумулятор
- Натрий-серный аккумулятор
- Никель-кадмиевый аккумулятор
- Никель-металл-гидридный аккумулятор
- Никель-цинковый аккумулятор
- Свинцово-водородный аккумулятор
- Свинцово-кислотный аккумулятор
- Свинцово-оловянный аккумулятор
- Серебряно-кадмиевый аккумулятор
- Серебряно-цинковый аккумулятор
- Цинк-бромный аккумулятор
- Цинк-воздушный аккумулятор
- Цинк-хлорный аккумулятор
Топливные элементы
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
- Смотри также Категория: Топливные элементы.
- Прямой метанольный топливный элемент.
- Твердооксидный топливный элемент.
- Щелочной топливный элемент.
СвеÑовÑе иÑÑоÑники
СвойÑÑво полÑпÑоводников ÑоздаваÑÑ ÐÐС пÑи попадании на Ð½Ð¸Ñ Ð¿Ð¾Ñока ÑвеÑа иÑполÑзÑеÑÑÑ Ð¿Ñи Ñоздании ÑвеÑовÑÑ Ð¸ÑÑоÑников поÑÑоÑнного Ñока.

ÐбÑединение болÑÑого колиÑеÑÑва кÑемниевÑÑ ÑÑÑÑкÑÑÑ Ð¿Ð¾Ð·Ð²Ð¾Ð»ÑÐµÑ ÑоздаваÑÑ ÑолнеÑнÑе баÑаÑеи. ÐеболÑÑие ÑлекÑÑоÑÑанÑии, ÑозданнÑе на базе ÑÐ°ÐºÐ¸Ñ ÑолнеÑнÑÑ Ð¿Ð°Ð½ÐµÐ»ÐµÐ¹, имеÑÑ Ð½Ð° ÑегоднÑÑний Ð´ÐµÐ½Ñ ÐÐРне более 15%.